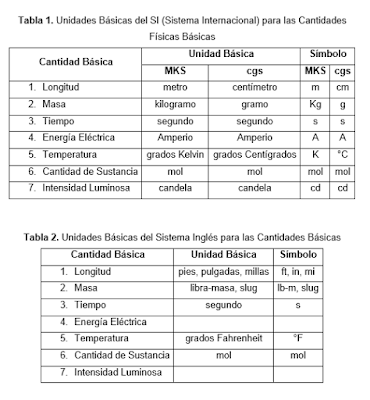
Autor: Juan Camilo Botero Ospina
(Ingeniero Químico, UdeA
CEO Aulamax)
Algunas sustancias pueden cambiar de
estado, es decir, cambiar su estado físico (o de agregación), cuando se les
adiciona o extrae energía en forma de calor. La temperatura es una
medida de la cantidad de calor que se adiciona, mientras no ocurra cambio de estado; sin embargo, en el tiempo en
que una cantidad dada de una sustancia se encuentre en el punto o temperatura específica donde cambia de estado, la temperatura
no cambiará hasta que “toda la masa” de dicha sustancia, pase de un estado físico
a otro, como se observa en la curva de
calentamiento para el agua de la Figura 1. La gráfica de la Figura 1,
se denomina curva de calentamiento, porque el proceso se lleva a cabo por adición
de calor; en cambio, si se analizara al contrario, es decir, al extraer calor,
se suele denominar curva de enfriamiento.
Los cambios de estado, son aquellos que no
implican un cambio en la naturaleza química de la sustancia, y solo implican un
cambio en su apariencia física. Por esto decimos que, el agua líquida sigue
siendo agua, aunque se evapore (vapor de agua) o se congele (hielo). Es decir,
el agua líquida, el vapor y el hielo, son la misma sustancia, aunque se
presenten de forma diferente ante nuestros ojos.
Los cambios de estado que presentan las
sustancias son los siguientes, dependiendo si se trata de una curva de calentamiento
o de enfriamiento.
Figura 1. Curva de calentamiento para el agua
PROCESO DE CAMBIOS DE ESTADO EN CURVAS DE CALENTAMIENTO
Fusión: Ocurre cuando toda la masa de una sustancia en
estado sólido pasa a estado líquido por medio de un calentamiento. La
temperatura de fusión es aquella a la cual una sustancia llega al punto de fusión.
Se ha establecido que, a nivel del mar, el agua alcanza su punto de fusión a 0
°C, y 1 atm de presión.
Ebullición: Sucede cuando toda la masa de una sustancia en
estado líquido pasa a estado vapor. La temperatura de ebullición es aquella a
la cual una sustancia llega al punto de ebullición. La ebullición y la
vaporización son muy similares, pero la diferencia es que, la ebullición es la
que implica un cambio de estado de toda la masa de líquido al vapor, pero la
vaporización se da en la superficie del líquido, y no tiene que ser que toda la
masa de líquido pase a la fase vapor. Se ha establecido que, a nivel del mar,
el agua alcanza su punto de ebullición a 100 °C, y 1 atm de presión.
Sublimación:
También conocida como sublimación progresiva. Ocurre cuando toda la masa de una
sustancia en estado sólido pasa al estado vapor, en forma directa, y sin que
pase por el estado líquido. La temperatura de sublimación es aquella a la cual
una sustancia alcanza el punto de sublimación. Por ejemplo, el yodo puede sublimar
porque su presión de vapor es muy alta, y a bajas temperaturas, dicha presión iguala con
facilidad la presión del medio, pasando directamente al estado de vapor. El
agua en estado sólido, bajo determinadas condiciones de temperatura y presión,
también puede sublimar.
PROCESO DE CAMBIOS DE ESTADO EN CURVAS DE ENFRIAMIENTO
Solidificación: Sucede cuando toda la masa de una sustancia en
estado líquido pasa a estado sólido. Por tanto, la solidificación es el proceso
contrario a la fusión, y ambas se dan a la misma temperatura (y en el mismo
intervalo de tiempo), pero en procesos contrarios. La temperatura de solidificación
se suele denominar punto de solidificación (compactación de las partículas del
metal), o también, punto de congelación como es el caso del agua (si se forman
cristales).
Condensación: Se da cuando toda la masa de una sustancia en estado
vapor pasa a estado líquido. Por tanto, la condensación es el proceso contrario
a la ebullición, y ambas se dan a la misma temperatura (y en el mismo intervalo
de tiempo), pero en procesos contrarios. La temperatura de condensación se
suele denominar punto de condensación. Hay que diferenciar entre condensación y
licuefacción. La licuefacción ocurre cuando una sustancia en estado gaseoso
pasa al estado líquido, y la temperatura a la cual se lleva a cabo dicho
proceso se llama punto de licuefacción.
Sublimación
inversa: También se denomina sublimación regresiva. Se da cuando toda la masa de
una sustancia en estado vapor puede pasar a estado sólido, sin pasar a través
del estado líquido. Es el proceso contrario a la sublimación (progresiva). La
temperatura de sublimación regresiva se denomina punto de sublimación
regresiva. Como ejemplo, también consideramos el yodo que en estado vapor puede
llevarse a estado sólido, sin que condense durante dicho proceso.
¿Cuál es la diferencia entre vapor y gas?
El
vapor es una sustancia que a condiciones normales (en otras palabras,
condiciones del ambiente) permanece en estado líquido (o sólido si sufre
sublimación), y que solo alcanza estado de vapor por adición de calor. En
cambio, el gas sigue siendo gas a condiciones normales. Por ejemplo, el agua se
puede convertir a vapor gracias al calentamiento, porque a condiciones
normales, el agua se encuentra en estado líquido; sin embargo, el oxígeno es un
gas porque a condiciones normales permanece como tal (no sufre cambio al estado
líquido).
¿Por qué no cambia el valor de la temperatura durante un cambio de
estado?
Durante
el proceso de fusión, las partículas de una sustancia en estado sólido coexisten
junto a las partículas en estado líquido. En otras palabras, no se evidencia un
aumento de la temperatura porque el calor que se adiciona durante este cambio
de estado se acumula en la sustancia a modo de energía interna que va
transformando físicamente a las sustancias desde el estado sólido al líquido.
Tal calor es conocido como calor latente,
ya que es absorbido por la sustancia solo y durante el tiempo que dure el
cambio de estado. Lo mismo que ocurre
para la fusión, sucede durante el proceso de ebullición.
¿Por qué cambia el valor de la temperatura cuando no hay cambio de
estado?
Cuando no hay cambio de estado, la adición
de calor se evidencia en el aumento de temperatura. La temperatura se emplea entonces
como una medida de la energía cinética de las partículas en el estado físico o
de agregación en que se encuentren, y, cada adición de calor implica un
incremento en la misma, porque no se emplea en la energía interna de
transformación física de las sustancias ya que no están cambiando de estado.
Este calor adicionado mientras no ocurra cambio de estado es el que se
denomina calor específico, y se ha
definido puntualmente, como la cantidad de energía en forma de calor necesaria
para aumentar en un grado centígrado la temperatura de una sustancia (sin que
ocurra cambio de estado).
Algunos aspectos básicos característicos de los estados de agregación
Estado sólido: Estado en el cual las partículas de una sustancia
se encuentran unidas por fuerzas de atracción intermoleculares altas, y no presentan
una velocidad cinética (velocidad del movimiento molecular). En el estado sólido,
las partículas se encuentran fuertemente unidades y ordenadas, sin importar si
se trata de partículas metálicas o de sólidos cristalinos. No presentan
fluidez, son partículas con una configuración rígida, por lo que adquieren una
forma independiente del recipiente que las pueda contener.
Estado
líquido: Estado en el cual las partículas de una sustancia se encuentran
unidas por fuerzas de atracción intermoleculares medias, y presentan una
velocidad cinética baja, por lo que se consideran como sustancias fluidas,
porque, a pesar de que las fuerzas de atracción entre las partículas son
significativas, no son lo suficientemente altas para mantener rígidas a las
partículas. Las partículas en el estado líquido adquieren la forma y el volumen
del recipiente que las contiene.
Estado
gaseoso: Estado en el cual las partículas de una sustancia presentan
fuerzas de atracción intermolecular despreciable, y presentan una alta energía
cinética, lo cual conlleva a que se puedan mover libremente por todo el espacio
disponible del recipiente que los contiene. Adoptan la forma del recipiente que
los contiene, pero su volumen depende de las variaciones de temperatura y presión,
para una masa constante de gas.
En la Figura 2, podemos observar las relaciones existentes entre los estados de agregación y los cambios de estado, para los procesos de calentamiento y de enfriamiento.
Figura 2. Representación de cambios de estados físicos o de agregación
Para ampliar tus conocimientos sobre los Estados de agregación de la Materia, te invito a estudiar nuestra lección sobre "Estados de la Materia":
#aulamax #cambiosdeestado #curvasdecalentamiento #sólido #líquido #vapor #gas #fusión #ebullición #evaporación #vaporización #condensación #solidificación #congelación #licuefacción #calentamiento #estado #agregación #materia